同源康醫藥(02410)肺癌腦轉移新藥艾多替尼上市申請獲正式受理並納入優先審評
時間:2026-02-06 17:51:33
同源康醫藥-B
智通財經APP獲悉,2月6日,同源康醫藥-B(02410)宣佈其自主研發的針對非小細胞肺癌(NSCLC)腦轉移的甲磺酸艾多替尼片(TY-9591)新藥上市申請(NDA)已獲得中國國家藥品監督管理局(NMPA)藥品審評中心(CDE)正式受理。這是首個針對肺癌腦轉移的新一代EGFR-TKI抑制劑。
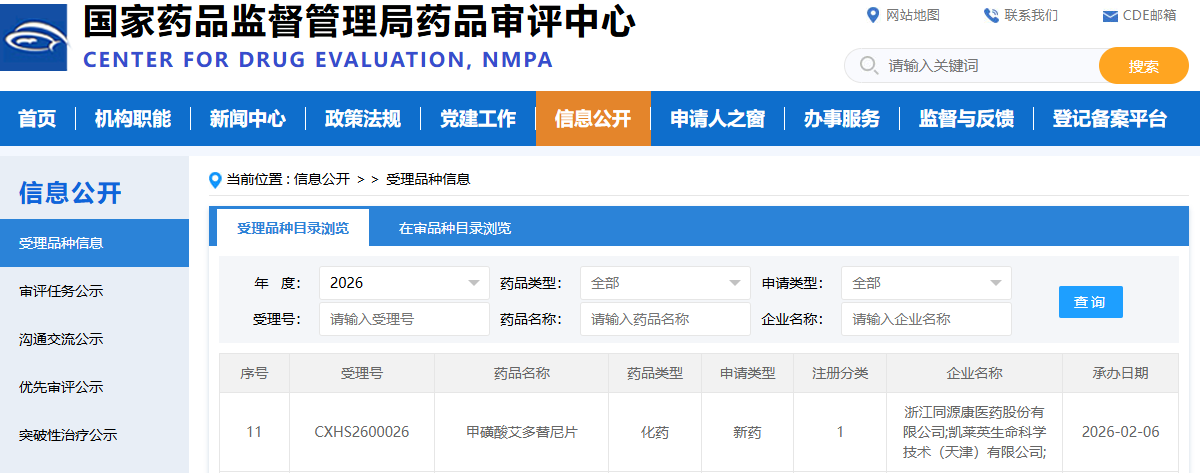
艾多替尼申報的適應症爲:具有表皮生長因子受體(EGFR)外顯子 19 缺失(19DEL)或外顯子 21(L858R)置換突變,並伴有中樞神經系統(CNS)轉移的局部晚期或轉移性非小細胞肺癌(NSCLC)成人患者的一線治療。
此次提交的NDA是基於一項在中國開展的多中心、隨機、開放標籤、陽性對照的關鍵註冊性臨牀研究(ESAONA)(NCT05948813)結果。該研究採用優效試驗設計,旨在評估甲磺酸艾多替尼片對比奧希替尼一線治療NSCLC腦轉移受試者的有效性和安全性,由中國醫學科學院腫瘤醫院石遠凱教授牽頭,全國50多家研究中心參加。此項研究的結果將於近期發佈於國際學術大會或學術期刊。
此前,2025 年 9 月,同源康醫藥在 WCLC 2025 大會上以口頭報告的形式展示了 ESAONA 研究的中期研究結果。截至 2025 年 2 月 28 日,基於 224 例患者數據的中期分析顯示:根據 RECIST v1.1標準評估,盲法獨立影像評估(BICR)顱內客觀緩解率(iORR)在艾多替尼組高達 92.8%,而奧希替尼組則爲 76.1%,p=0.0006。根據 RANO-BM 評估標準,研究者評估的確認 iORR 爲 90.1% vs 74.3%,p=0.0023,均具有臨牀意義的顯著性差異。亞組分析顯示,艾多替尼各亞組的iORR結果和整體結果趨勢一致,在數據值上均高於奧希替尼組。其中女性、<65歲、從不吸菸、ECOG評分1分、19號外顯子缺失、顱內病竈數量≤3以及未發生內臟轉移的受試者,兩組間比較差異有統計學意義。顱內無進展生存期(iPFS),全身無進展生存期(PFS)和總生存期(OS)尚未成熟。
2026年1月,艾多替尼已被國家藥品監督管理局藥品評審中心納入優先審評審批程序,這將進一步加速艾多替尼的上市。
此外,艾多替尼單藥及聯合用藥的多個研究正在中國開展。
中國醫學科學院腫瘤醫院石遠凱教授:肺癌腦轉移是臨牀治療的一大挑戰,不僅嚴重影響患者的生活質量和神經認知功能,更是導致臨牀治療失敗和患者死亡的主要原因之一。現有臨牀數據表明,艾多替尼單藥治療肺癌腦轉移展示出令人鼓舞的臨牀療效和良好的安全性,我們期待該藥物能早日獲批上市,爲肺癌腦轉移患者帶來更多的治療選擇。
同源康醫藥高級副總裁陳修貴先生:艾多替尼是同源康醫藥首個遞交NDA的自研產品,也是公司根據未滿足臨牀需求,差異化、科學地產品開發的成果。在此特別感謝參與該研究的所有研究者與患者、CRO和各供應商的努力和信任。此次NDA提交的資料均嚴格遵循NMPA的技術要求和合格標準,我們將與監管部門密切配合,推動這一重要產品早日獲批,服務廣大肺癌腦轉移患者。同時也將進一步探索聯合用藥的臨牀研究,解決更多患者的臨牀實際需求。
同源康醫藥董事長兼CEO吳豫生博士:同源康自成立以來,一直專注於新藥研創,共同探尋健康之源。艾多替尼遞交NDA是公司一項重要里程碑進展,也標誌着同源康醫藥將進入商業化階段。基於全球同類最優的臨牀數據,我們相信艾多替尼將爲肺癌腦轉移患者帶來新的希望。此次遞交NDA只是一個開始,我們一直致力於解決未被滿足的臨牀需求,繼續深耕腫瘤領域,一如既往地堅持創新,以臨牀價值爲導向研發更多更好的新藥,不斷滿足老百姓對於幸福美好生活的追求,造福廣大患者。
關於艾多替尼
甲磺酸艾多替尼片是同源康醫藥自主研製的一種高效、ATP 競爭性、不可逆的口服新一代高選擇性EGFR-TKI,爲已上市同類藥物奧希替尼的氘代產品,與奧希替尼相比具有不同的藥代動力學特徵,可顯著減少毒性代謝產物AZD5104 (TY9591-D1)的產生,具有明顯的臨牀優勢,尤其針對肺癌腦轉移和EGFR L858R敏感突變NSCLC患者療效顯著。同源康醫藥已在中國開展多項單藥及聯合用藥治療晚期NSCLC患者的臨牀試驗。
關於同源康醫藥
同源康醫藥是一家國際化的創新生物製藥公司,專注於研究和開發新一代激酶抑制劑,以滿足癌症治療中未滿足的臨牀需求。自2017年成立以來,同源康醫藥已開發十多個創新品種,覆蓋自PCC至III期臨牀試驗的多個階段。公司致力於爲患者提供更有效更安全的抗腫瘤藥物。
免責聲明:本資訊不構成建議或操作邀約,市場有風險,投資需謹慎!


